近日,疼痛研究领域TOP期刊PAIN以Research paper的形式在线发表了苏州大学苏州医学院小草嫩芽研究视频徐广银教授团队的研究论文“A Paraventricular Hypothalamic Nucleus Input to Ventral of Lateral Septal Nucleus Controls Chronic Visceral Pain”,并作为Editor’s choice article,受邀发表视频摘要,这项研究解析了内脏疼痛行为的神经环路调控机制。
肠易激综合征(Irritable bowel syndrome,IBS)是一种以腹痛和排便习惯改变为特征的功能性胃肠道疾病,在人群中具有较高的发病率[1; 2]。越来越多的证据表明,与健康人群相比,IBS患者更可能的经历过创伤和心理压力应激,尤其是早期生活压力[3; 4]。早期生活压力可能会导致大脑功能和内脏对刺激敏感性的长期变化[5]。新生期母爱剥夺(neonatal maternal deprivation,NMD)作为一种典型的早期生活压力应激,已被证明可诱发动物产生内脏疼痛行为[6; 7]。目前,关于内脏疼痛的研究大多集中于外周神经系统和脊髓层次的分子机制,聚焦在大脑层次的研究非常有限,导致大脑对内脏疼痛中的调控作用在很大程度上仍不清楚。但是大脑作为高级中枢对痛觉的调控具有至关重要的作用,从大脑神经环路的角度探究内脏疼痛的机制或许能够得到更好的解释。因此,研究人员尝试从神经环路的角度去探讨大脑对内脏痛的调控机制,以期为IBS患者找寻新的治疗靶点和策略。
为了探究哪些脑区能够被内脏疼痛行为所激活,研究人员首先通过c-fos染色和光纤记录系统来进行检测。在给予小鼠结直肠扩张(CRD)时,LSV神经元的钙活动剧烈增加,并且NMD小鼠增加的更加显著。然而,给予小鼠体表刺激时,LSV神经元的钙活动没有明显的改变,提示LSV脑区或许对内脏痛行为存在一定的特异性。
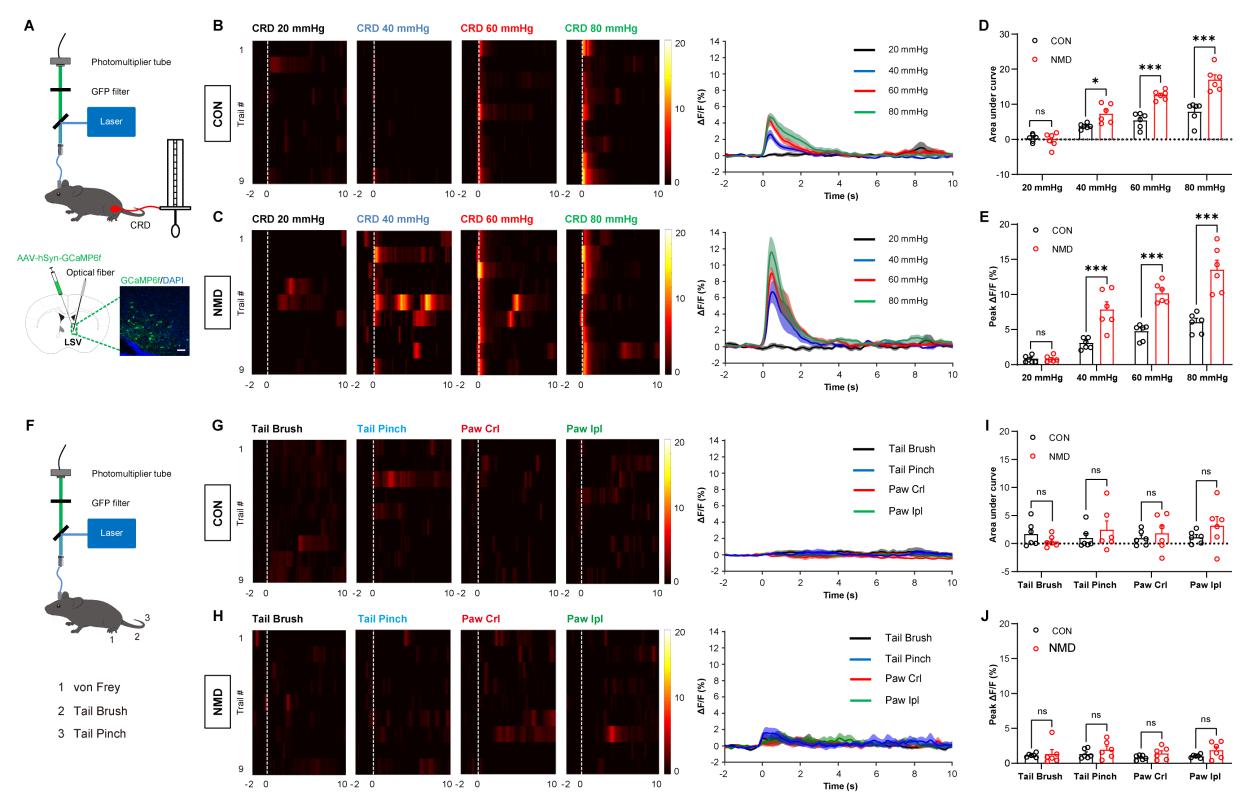
图一:内脏刺激和体表刺激下LSV脑区神经元的钙信号变化。
随后,研究人员进一步的检测了内脏疼痛刺激激活LSV脑区神经元的具体类型,发现被激活是主要是CaMKIIα 阳性的神经元,并且通过光遗传学调控LSV脑区CaMKIIα 阳性神经元的活性,发现能够改变小鼠的内脏痛行为。
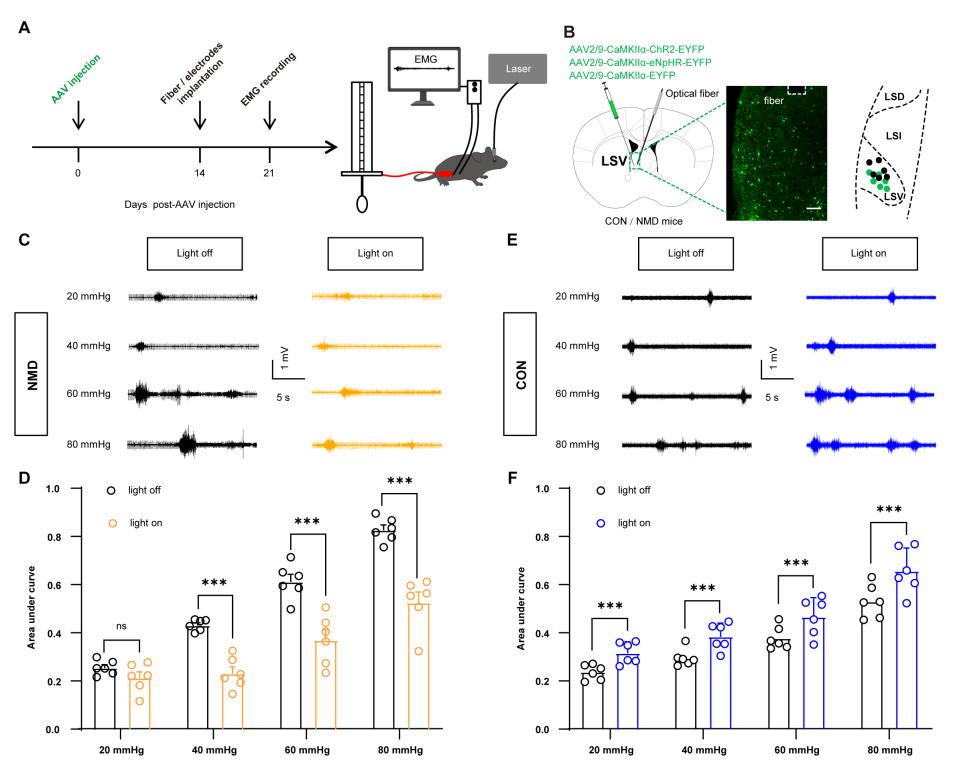
图二:光遗传调控LSV脑区CaMKIIα 阳性神经元的活性改变小鼠的内脏痛行为。
在证明了LSV脑区CaMKIIα 阳性神经元对内脏痛行为的调控作用之后,研究人员通过病毒示踪的方式,发现PVH的CaMKIIα 阳性神经元对LSV有着顺行的投射,并且PVH的CaMKIIα 阳性神经元也被内脏痛刺激大量的激活,提示PVH可能在内脏痛调控中发挥重要的作用。

图三:PVH-LSV环路解析。
随后研究人员通过光纤记录系统进一步的证明了PVH的CaMKIIα 阳性神经元被内脏痛刺激大量的激活,并且发现通过光遗传调控PVH的CaMKIIα 阳性神经元能够改变小鼠的内脏痛行为。
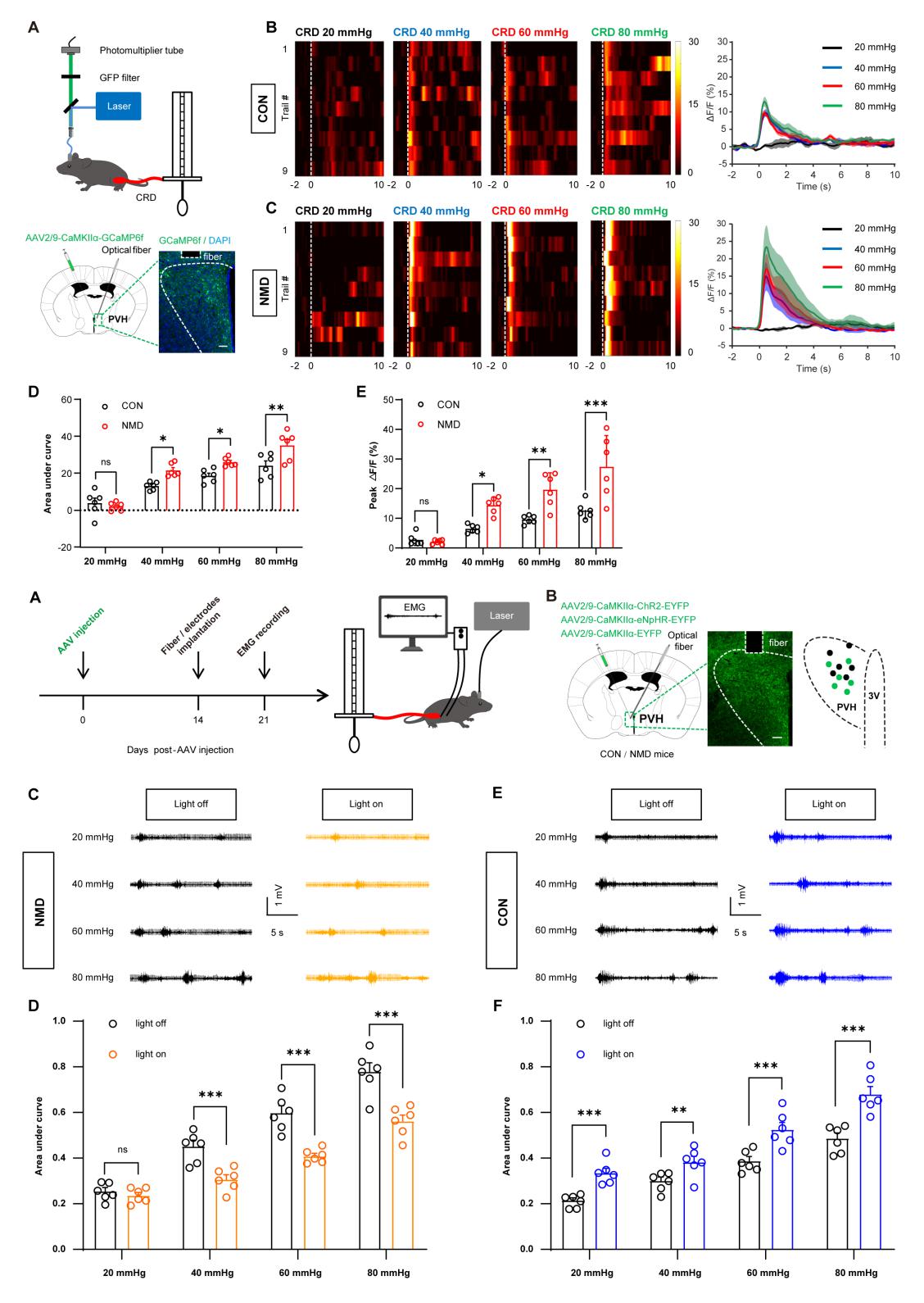
图四:光遗传调控PVH脑区CaMKIIα 阳性神经元的活性改变小鼠的内脏痛行为。
LSV和PVH都对内脏痛行为有着重要的调控作用,并且PVH是LSV的上游核团,提示可能是PVH-LSV环路在发挥调控作用。因此,研究人员通过光遗传结合化学遗传的方式验证了PVH-LSV环路对内脏痛行为的作用,发现调控PVH-LSV环路的活性能够显著改变小鼠的内脏痛行为,证明了PVH-LSV环路介导了内脏痛行为的改变。
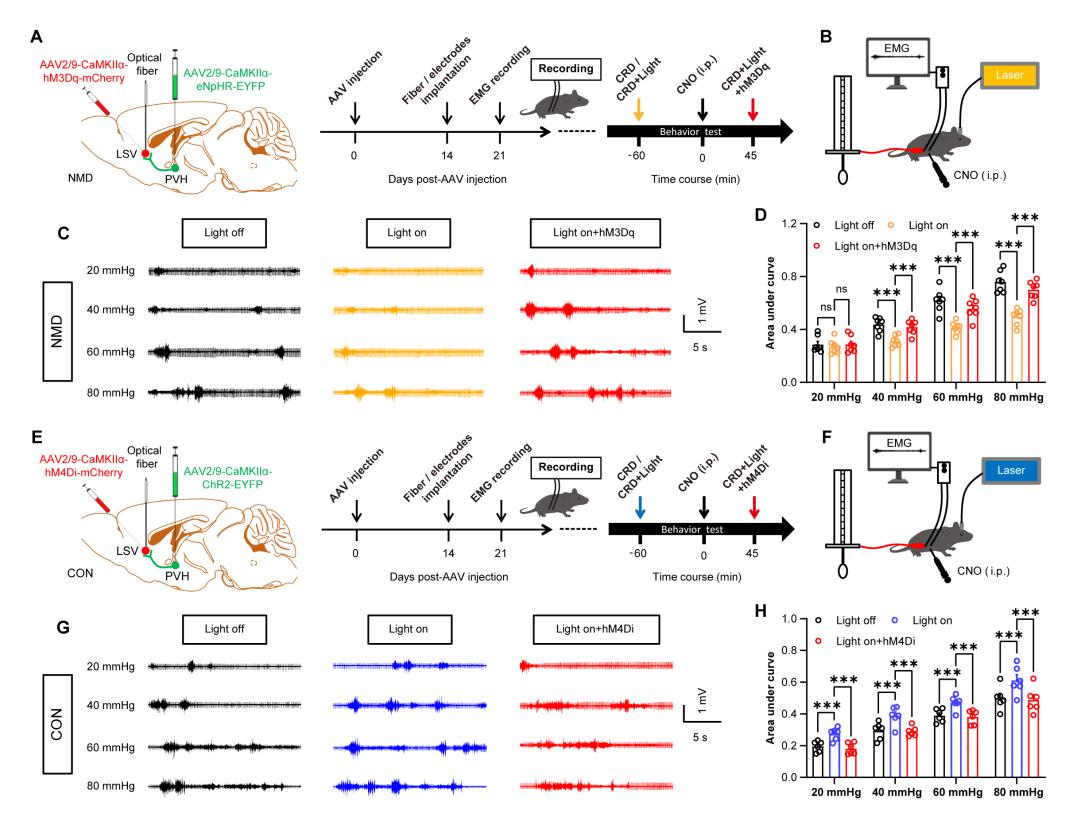
图五: PVH-LSV神经环路介导小鼠的内脏痛行为。
苏州大学苏州医学院小草嫩芽研究视频的博士研究生李永昌为第一作者,苏州大学附属儿童医院王谦教授为本文共同第一作者,苏州医学院徐广银教授为通讯作者。该研究得到了国家自然科学基金(81920108016;31730040)的大力支持。
原文链接:http://dx.doi.org/10.1097/j.pain.0000000000002750
参考文献:
1. Enck P, Aziz Q, Barbara G, Farmer AD, Fukudo S, Mayer EA, Niesler B, Quigley EM, Rajilic-Stojanovic M, Schemann M, Schwille-Kiuntke J, Simren M, Zipfel S, Spiller RC. Irritable bowel syndrome. Nature reviews Disease primers 2016;2:16014.
2. Raskov H, Burcharth J, Pommergaard HC, Rosenberg J. Irritable bowel syndrome, the microbiota and the gut-brain axis. Gut microbes 2016;7(5):365-383.
3. Fuentes IM, Christianson JA. The Influence of Early Life Experience on Visceral Pain. Frontiers in systems neuroscience 2018;12:2.
4. Hagiwara H, Sakimura K, Abe M, Itoi K, Kamiya Y, Akema T, Funabashi T. Sex differences in pain-induced modulation of corticotropin-releasing hormone neurons in the dorsolateral part of the stria terminalis in mice. Brain research 2021;1773:147688.
5. Chitkara DK, van Tilburg MA, Blois-Martin N, Whitehead WE. Early life risk factors that contribute to irritable bowel syndrome in adults: a systematic review. The American journal of gastroenterology 2008;103(3):765-774; quiz 775.
6. Holschneider DP, Guo Y, Mayer EA, Wang Z. Early life stress elicits visceral hyperalgesia and functional reorganization of pain circuits in adult rats. Neurobiology of stress 2016;3:8-22.
7. Li YC, Tian YQ, Wu YY, Xu YC, Zhang PA, Sha J, Xu GY. Upregulation of Spinal ASIC1 and NKCC1 Expression Contributes to Chronic Visceral Pain in Rats. Frontiers in molecular neuroscience 2020;13:611179.

