近日,疼痛研究领域TOP期刊PAIN 以Research paper的形式在线发表了苏州大学苏州医学院小草嫩芽研究视频徐广银教授团队的研究论文“miR-1306-3p directly activates P2X3Rs in primary sensory neurons to induce visceral pain in rats”,并作为Editor’s choice article,受邀发表视频摘要,这项研究解析了miRNA-P2X3R在内脏疼痛行为的发生、发展中的新机制。

肠易激综合征 (Irritable Bowel Syndrome,IBS)是临床上最常见的胃肠道功能紊乱的疾病之一,也是慢性内脏痛的典型临床疾病的代表,其突出症状就是伴随排便习惯及粪便形状改变的腹痛,在全球的发病率高达10%~25%[1]。IBS诱导因素繁多,病理机制复杂且尚不清楚,目前仍缺乏有效的治疗手段,严重降低了人们的生活质量和工作效率。目前关于其最新机制报道均集中在中枢神经环路[2-4],而在外周鲜有报道。因此,迫切需要对IBS的生理学和病理生理学进行更多的基础研究,为未来的药物开发提供新的理论支持和治疗靶点。
许多通道/受体,包括离子型通道和代谢性受体,都与疼痛信号的产生和传递有关[4;5]。其中,嘌呤能P2X受体通道在慢性内脏痛中发挥关键作用[6;7]。值得注意的是,P2X3R在DRG中的表达水平明显高于其他受体亚型[8]。
ATP作为P2X3R的正位配体,是一种著名的细胞外信号分子,广泛存在于外周神经系统或周围组织中。细胞外ATP通过激活细胞膜上两种类型的P2嘌呤能受体(P2X和P2Y)来触发下游信号,导致外周敏化[9]。但是通过P2X受体的阻断剂阻断ATP结合并不能完全缓解痛敏,其具体机制有待阐明。
众所周知,miRNA参与各种生理和病理过程,除了影响通道蛋白表达的作用外影响通道蛋白的表达[10],最近的一项研究表明,miR-711与DRG神经元上TRPA1受体的细胞外片段结合。激活TRPA1通道,改变下游信号传导途径,并最终影响外周神经发生。最终导致瘙痒的外周神经发生[11]。最近的研究表明有大量的细胞外的miRNAs与P2X3受体的表达和功能有关[12]。 然而,目前是否有miRNAs直接激活 P2X3受体的细胞外片段还不清楚。
本课题组前期研究表明慢性内脏疼痛的大鼠模型中miR-1306-3p在DRG神经元中的表达显著升高。此外,前期已经证明P2X3Rs参与慢性内脏疼痛[6]。因此,在本研究中,作者假设上调的miR-1306-3p通过直接与DRG神经元中的P2X3受体相互作用而导致慢性内脏疼痛。通过膜片钳记录、基因沉默和计算机模拟等一系列技术,作者验证了miR-1306-3p能快速诱发动作电位和诱导大鼠DRG神经元产生内向电流。
进一步的实验揭示了 miR-1306-3p在P2X3R胞外结构上的关键作用位点。更重要的是,该研究表明,ATP拮抗剂和miRNA-antagomir的联合应用可以成为一种新的和潜在的用于治疗慢性内脏疼痛患者的策略。
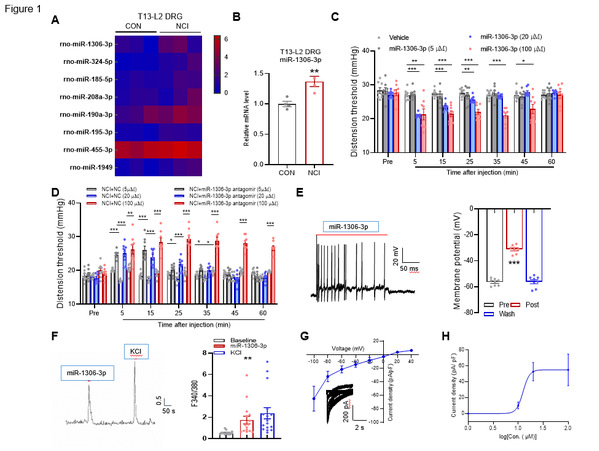
图1 DRG神经元miR-1306-3p介导慢性内脏痛
研究者首先通过基因芯片技术从NCI大鼠模型中筛选出与正常组有差异表达的miRNA, 发现miR-1306-3p 在肠相关DRG组织中表达增加,而在其他组织中没有变化。鞘内注射miR-1306-3p 可以降低内脏痛阈值,使用其拮抗剂可以翻转。
进一步通过电生理技术对筛出的miRNA进行检测发现,miR-1306-3p可以诱发DRG神经元产生动作电位,而其他的miRNAs则不能。钙成像实验结果也显示,miR-1306-3p可以引起明显的钙反应(如图1)。以上结果可推测,miR-1306-3p引起内脏痛的反应是通过激活了DRG神经元的兴奋性。
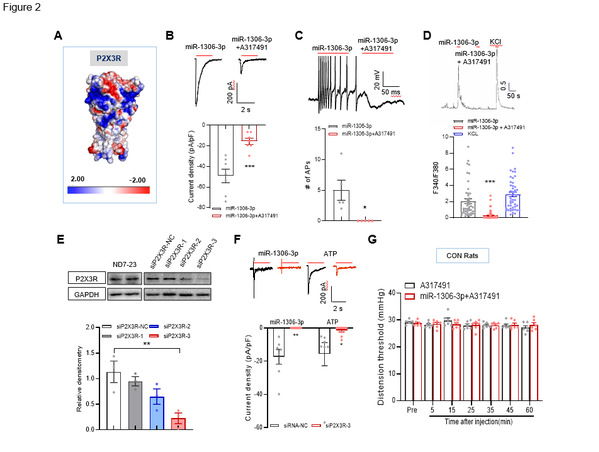
图2 miR-1306-3p通过P2X3R激活DRG神经元
为进一步验证miR-1306-3p诱发DRG神经元产生内相电流的机制,本研究对DRG神经元上的阳离子通道进行了筛选。首先,通过计算机模拟计算了P2X3R表面可以结合miR-1306-3p,发现P2X3R的拮抗剂可以显著抑制miR-1306-3p诱发的内相电流,动作电位及钙反应。当P2X3R基因沉默表达后,miR-1306-3p不能在诱发内相电流,而P2X3R的拮抗剂也翻转了miR-1306-3p诱发的内脏痛(如图2)。以上结果强烈提示miR-1306-3p通过激活DRG神经元上的P2X3R诱发内向电流。
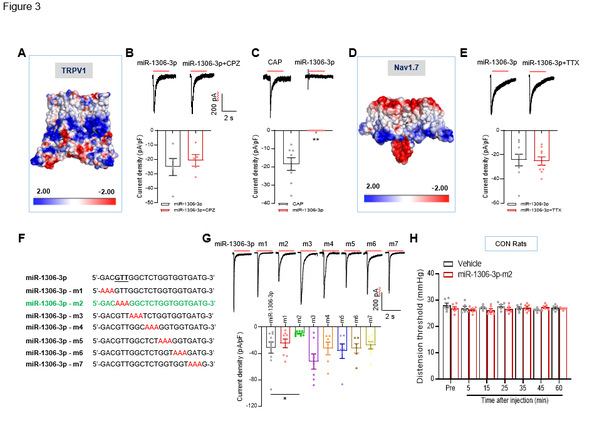
图3 miR-1306-3p 通过其核心序列与P2X3R结合激活DRG神经元
同时,研究者利用同样的方法对DRG神经元上的TPRV1和Nav1.7进行验证发现,TPRV1和Nav1.7的拮抗剂均不能阻断miR-1306-3p诱发的内向电流。该结果进一步证明了以上结论。有趣的是,作者通过对miR-1306-3p序列进行不同点突变,发现其中GTT三个碱基在与P2X3R结合中发挥着重要作用(如图3)。
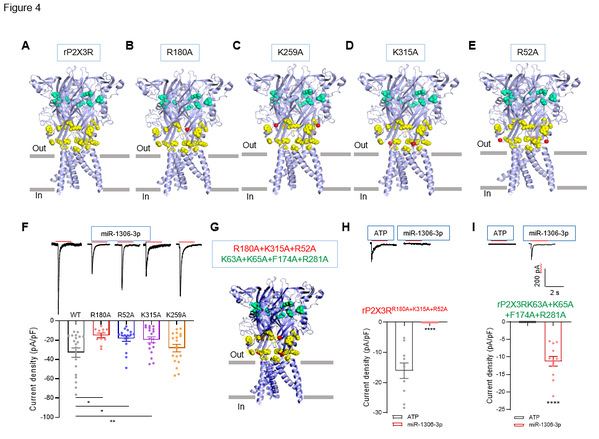
图4 miR-1306-3p与P2X3R上的特定氨基酸结合区别于ATP位点
紧接着,研究者通过计算机模拟软件对P2X3R上与miR-1306-3p结合的重要氨基酸位点进行预测并构建不同点突变的质粒,通过电生理的方法进一步进行验证发现,P2X3R上的R180, K315 and R52三个位点的突变显著降低miR-1306-3p诱发的内向电流。而当这三个氨基酸同时突变时,miR-1306-3p不能诱发内向电流,相反,当把ATP结合位点突变后,miR-1306-3p还可诱发部分内向电流(如图4),由此提示miR-1306-3p与ATP在P2X3R上的结合位点不一致。
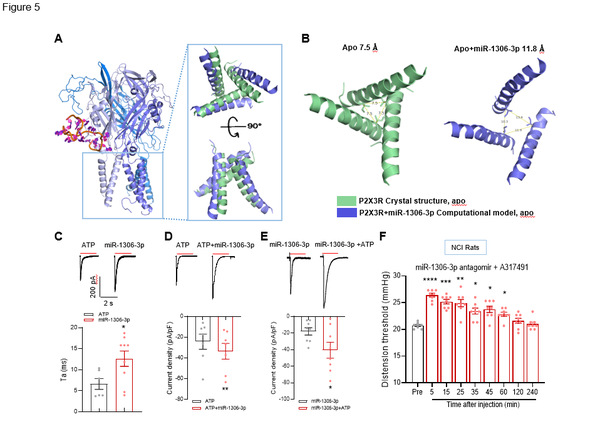
图5 miR-1306-3p与P2X3R结合复合物的分子动力学平衡构象
通过计算机模拟软件进一步预测发现,当miR-1306-3p与P2X3R结合时,可以使P2X3R的离子孔径比关闭态从7.5 Å 扩大到11.8 Å,而使其开放态维持时间也增加,推测更有利于阳离子进入。研究者从电生理角度也进一步验证了这一结果,miR-1306-3p增加了ATP电流密度。当miR-1306-3p antagomir和P2X3R的拮抗剂联合使用,更有效的缓减了慢性内脏痛(如图5)。
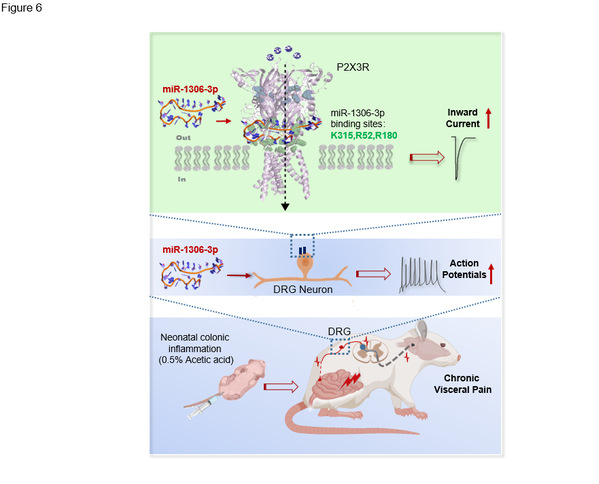
图6 miR-1306-3p 与P2X3R通道在慢性内脏痛中的作用机制模式图
慢性内脏疼痛是对全球公共健康卫生的主要威胁之一。慢性内脏疼痛发病机制的基本知识对临床治疗和预防该病至关重要。本研究主要阐明miR-1306-3p与初级感觉传入神经元上的P2X3Rs结合的神经机制,即miR-1306-3p的核心序列与P2X3Rs上的关键氨基酸结合,激活P2X3Rs,诱导产生内向电流,增加DRG神经元的兴奋性,最终产生内脏疼痛(图6)。
该研究还表明,协同应用miR-1306-3p antagomir和A317491能减弱NCI大鼠的内脏疼痛行为,表明联合使用拮抗剂阻断ATP和miR-1306-3p的两个结合位点是一种有用的新策略。本研究不仅揭示了miRNAs作用的新机制,而且还提出了治疗肠易激综合征患者伴随慢性内脏疼痛的新策略。
原文链接:
参考文献:
[1] Burnstock G. Physiology and pathophysiology of purinergic neurotransmission. Physiological reviews 2007;87(2):659-797.
[2] Li YC, Wang Q, Li MG, Hu SF, Xu GY. A paraventricular hypothalamic nucleus input to ventral of lateral septal nucleus controls chronic visceral pain. Pain 2022.
[3] Xu QY, Zhang HL, Du H, Li YC, Ji FH, Li R, Xu GY. Identification of a Glutamatergic Claustrum-Anterior Cingulate Cortex Circuit for Visceral Pain Processing. J Neurosci 2022;42(43):8154-8168.
[4] Zhou YL, Jiang GQ, Wei J, Zhang HH, Chen W, Zhu H, Hu S, Jiang X, Xu GY. Enhanced binding capability of nuclear factor-κB with demethylated P2X3 receptor gene contributes to cancer pain in rats. Pain 2015;156(10):1892-1905.
[5] Zhang HH, Hu J, Zhou YL, Qin X, Song ZY, Yang PP, Hu S, Jiang X, Xu GY. Promoted Interaction of Nuclear Factor-κB With Demethylated Purinergic P2X3 Receptor Gene Contributes to Neuropathic Pain in Rats With Diabetes. Diabetes 2015;64(12):4272-4284.
[6] Xu GY, Shenoy M, Winston JH, Mittal S, Pasricha PJ. P2X receptor-mediated visceral hyperalgesia in a rat model of chronic visceral hypersensitivity. Gut 2008;57(9):1230-1237.
[7] Wu YY, Zhang HL, Lu X, Du H, Li YC, Zhang PA, Xu GY. Targeting GATA1 and p2x7r Locus Binding in Spinal Astrocytes Suppresses Chronic Visceral Pain by Promoting DNA Demethylation. Neurosci Bull 2022;38(4):359-372.
[8] Lewis C, Neidhart S, Holy C, North RA, Buell G, Surprenant A. Coexpression of P2X2 and P2X3 receptor subunits can account for ATP-gated currents in sensory neurons. Nature 1995;377(6548):432-435.
[9] Xu GY, Huang LY. Ca2+/calmodulin-dependent protein kinase II potentiates ATP responses by promoting trafficking of P2X receptors. Proc Natl Acad Sci U S A 2004;101(32):11868-11873.
[10] Chen L, Liu YW, Yue K, Ru Q, Xiong Q, Ma BM, Tian X, Li CY. Differential expression of ATP-gated P2X receptors in DRG between chronic neuropathic pain and visceralgia rat models. Purinergic signalling 2016;12(1):79-87.
[11] Han Q, Liu D, Convertino M, Wang Z, Jiang C, Kim YH, Luo X, Zhang X, Nackley A, Dokholyan NV, Ji RR. miRNA-711 Binds and Activates TRPA1 Extracellularly to Evoke Acute and Chronic Pruritus. Neuron 2018;99(3):449-463.e446.
[12] Wu R, Zhang PA, Liu X, Zhou Y, Xu M, Jiang X, Yan J, Xu GY. Decreased miR-325-5p Contributes to Visceral Hypersensitivity Through Post-transcriptional Upregulation of CCL2 in Rat Dorsal Root Ganglia. Neuroscience bulletin 2019;35(5):791-801.
